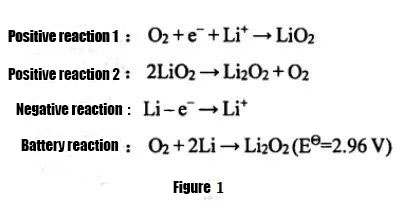01 باتری های لیتیوم هوا و باتری های لیتیوم گوگرد چیست؟
① باتری لیتیوم هوا
باتری لیتیوم-هوا از اکسیژن به عنوان واکنش دهنده الکترود مثبت و از لیتیوم فلزی به عنوان الکترود منفی استفاده می کند.چگالی انرژی نظری بالایی دارد (3500wh/kg) و چگالی انرژی واقعی آن می تواند به 500-1000wh/kg برسد که بسیار بالاتر از سیستم باتری لیتیوم یون معمولی است.باتری های لیتیوم هوا از الکترودهای مثبت، الکترولیت ها و الکترودهای منفی تشکیل شده اند.در سیستم های باتری غیرآبی، در حال حاضر از اکسیژن خالص به عنوان گاز واکنش استفاده می شود، بنابراین باتری های لیتیوم-هوا را می توان باتری های لیتیوم-اکسیژن نیز نامید.
در سال 1996، آبراهام و همکاران.اولین باتری لیتیوم-هوای غیرآبی را با موفقیت در آزمایشگاه مونتاژ کرد.سپس محققان شروع به توجه به واکنش الکتروشیمیایی داخلی و مکانیسم باتریهای لیتیوم-هوای غیرآبی کردند.در سال 2002، Read et al.دریافتند که عملکرد الکتروشیمیایی باتری های لیتیوم-هوا به حلال الکترولیت و مواد کاتد هوا بستگی دارد.در سال 2006، اوگاساوارا و همکاران.با استفاده از طیف سنج جرمی، برای اولین بار ثابت شد که Li2O2 اکسید شده و اکسیژن در طول شارژ آزاد می شود، که برگشت پذیری الکتروشیمیایی Li2O2 را تایید می کند.بنابراین، باتری های لیتیوم-هوا مورد توجه و توسعه سریع قرار گرفته اند.
② باتری لیتیوم گوگرد
باتری لیتیوم-گوگرد یک سیستم باتری ثانویه است که بر اساس واکنش برگشت پذیر گوگرد با ظرفیت ویژه بالا (1675 میلی آمپر ساعت بر گرم) و فلز لیتیوم (3860 میلی آمپر ساعت بر گرم) با ولتاژ تخلیه متوسط حدود 2.15 ولت است.چگالی انرژی نظری آن می تواند به 2600wh/kg برسد.مواد اولیه آن دارای مزایای کم هزینه و سازگاری با محیط زیست است، بنابراین پتانسیل توسعه زیادی دارد.اختراع باتری های لیتیوم سولفور را می توان به دهه 1960 ردیابی کرد، زمانی که هربرت و اولام برای ثبت اختراع باتری اقدام کردند.نمونه اولیه این باتری لیتیوم-گوگرد از لیتیوم یا آلیاژ لیتیوم به عنوان ماده الکترود منفی، گوگرد به عنوان ماده الکترود مثبت و از آمین های اشباع آلیفاتیک استفاده می شود.از الکترولیتچند سال بعد، باتری های لیتیوم گوگرد با معرفی حلال های آلی مانند PC، DMSO و DMF بهبود یافتند و باتری های 2.35-2.5 ولت به دست آمد.در اواخر دهه 1980 ثابت شد که اترها در باتری های لیتیوم-گوگرد مفید هستند.در مطالعات بعدی، کشف الکترولیت های مبتنی بر اتر، استفاده از LiNO3 به عنوان یک افزودنی الکترولیت، و پیشنهاد الکترودهای مثبت کامپوزیت کربن/گوگرد، رونق تحقیقاتی باتری های لیتیوم-گوگرد را باز کرده است.
02 اصل کار باتری لیتیوم هوا و باتری لیتیوم گوگرد
① باتری لیتیوم هوا
با توجه به حالت های مختلف الکترولیت مورد استفاده، باتری های لیتیوم هوا را می توان به سیستم های آبی، سیستم های آلی، سیستم های هیبریدی آب-آلی و باتری های لیتیوم-هوای تمام حالت جامد تقسیم کرد.از جمله، به دلیل ظرفیت ویژه کم باتری های لیتیوم-هوا با استفاده از الکترولیت های مبتنی بر آب، مشکلات در محافظت از فلز لیتیوم و برگشت پذیری ضعیف سیستم، باتری های لیتیوم-هوا آلی غیرآبی و لیتیوم-هوای تمام حالت جامد. در حال حاضر باتری ها بیشتر مورد استفاده قرار می گیرند.پژوهش.باتری های لیتیوم-هوای غیرآبی برای اولین بار توسط آبراهام و زی جیانگ در سال 1996 پیشنهاد شدند. معادله واکنش تخلیه در شکل 1 نشان داده شده است. واکنش شارژ برعکس است.الکترولیت عمدتاً از الکترولیت آلی یا الکترولیت جامد استفاده می کند و محصول تخلیه عمدتاً Li2O2 است ، محصول در الکترولیت نامحلول است و به راحتی روی الکترود مثبت هوا جمع می شود و بر ظرفیت تخلیه باتری لیتیوم هوا تأثیر می گذارد.
باتریهای لیتیوم هوا دارای مزایای چگالی انرژی فوقالعاده بالا، سازگاری با محیطزیست و قیمت پایین هستند، اما تحقیقات آنها هنوز در مراحل ابتدایی است و هنوز مشکلات زیادی وجود دارد که باید حل شوند، مانند کاتالیز واکنش کاهش اکسیژن، نفوذپذیری اکسیژن و آبگریزی الکترودهای هوا و غیرفعال شدن الکترودهای هوا و غیره.
② باتری لیتیوم گوگرد
باتری های لیتیوم گوگرد عمدتاً از گوگرد عنصری یا ترکیبات مبتنی بر گوگرد به عنوان ماده الکترود مثبت باتری استفاده می کنند و لیتیوم فلزی عمدتاً برای الکترود منفی استفاده می شود.در طی فرآیند تخلیه، لیتیوم فلزی واقع در الکترود منفی اکسید می شود تا یک الکترون از دست بدهد و یون های لیتیوم تولید کند.سپس الکترون ها از طریق مدار خارجی به الکترود مثبت منتقل می شوند و یون های لیتیوم تولید شده نیز از طریق الکترولیت به الکترود مثبت منتقل می شوند تا با گوگرد واکنش دهند و پلی سولفید تشکیل دهند.لیتیوم (LiPSs) و سپس واکنش بیشتر برای تولید سولفید لیتیوم برای تکمیل فرآیند تخلیه.در طول فرآیند شارژ، یونهای لیتیوم در LiPS از طریق الکترولیت به الکترود منفی برمیگردند، در حالی که الکترونها از طریق یک مدار خارجی به الکترود منفی برمیگردند تا فلز لیتیوم را با یونهای لیتیوم تشکیل دهند، و LiPSs در الکترود مثبت به گوگرد کاهش مییابد تا کامل شود. فرآیند شارژ
فرآیند تخلیه باتری های لیتیوم-گوگرد عمدتاً یک واکنش الکتروشیمیایی پیچیده چند مرحله ای، چند الکترونی و چند فازی روی کاتد گوگرد است و LiPS ها با طول زنجیره های مختلف در طی فرآیند شارژ-تخلیه به یکدیگر تبدیل می شوند.در طول فرآیند تخلیه، واکنشی که ممکن است در الکترود مثبت رخ دهد در شکل 2 و واکنش در الکترود منفی در شکل 3 نشان داده شده است.
مزایای باتری های لیتیوم گوگرد بسیار آشکار است، مانند ظرفیت نظری بسیار بالا.هیچ اکسیژنی در مواد وجود ندارد و واکنش تکامل اکسیژن رخ نخواهد داد، بنابراین عملکرد ایمنی خوب است.منابع گوگرد فراوان و گوگرد عنصری ارزان است.سازگار با محیط زیست است و سمیت کمی دارد.با این حال، باتری های لیتیوم سولفور نیز دارای برخی مشکلات چالش برانگیز هستند، مانند اثر شاتل لیتیوم پلی سولفید.عایق گوگرد عنصری و محصولات تخلیه آن؛مشکل تغییرات حجم زیاد؛SEI ناپایدار و مشکلات ایمنی ناشی از آندهای لیتیوم.پدیده خود تخلیه و غیره
به عنوان نسل جدیدی از سیستم باتری ثانویه، باتری های لیتیوم-هوا و باتری های لیتیوم-گوگرد دارای مقادیر ظرفیت ویژه نظری بسیار بالایی هستند و توجه گسترده محققان و بازار باتری های ثانویه را به خود جلب کرده اند.در حال حاضر این دو باتری همچنان با مشکلات علمی و فنی زیادی مواجه هستند.آنها در مرحله تحقیقات اولیه توسعه باتری هستند.علاوه بر ظرفیت خاص و پایداری مواد کاتد باتری که نیاز به بهبود بیشتر دارد، مسائل کلیدی مانند ایمنی باتری نیز باید فوراً حل شود.در آینده، این دو نوع جدید باتری همچنان به بهبود فنی مستمر نیاز دارند تا عیوب خود را از بین ببرند تا چشمانداز کاربرد گستردهتری را باز کنند.
زمان ارسال: آوریل-07-2023